Cosa sono i carboidrati?
I carboidrati sono i componenti organici più abbondanti nel regno vegetale e hanno formula generale Cn(H2O)m.
I carboidrati si dividono in:
- Monosaccaridi (o zuccheri semplici): sono carboidrati che non possono essere ulteriormente idrolizzati a composti più semplici.
- Disaccaridi: sono carboidrati formati da due unità di monosaccaridi uniti mediante legame glicosidico (vedi articolo: http://chimicaliceo.altervista.org/disaccaridi/)
- Oligosaccaridi: contengono almeno due unità (in genere non più di alcune) di monosaccaridi. Es: trisaccaridi e così via.
- Polisaccaridi: contengono numerose unità di monosaccaride (fino a migliaia) di solito identiche.
Legame glicosidico
Il legame che si forma tra le molecole di monosaccaride è detto legame glicosidico e deriva dalla reazione di condensazione tra un gruppo alcolico di una molecola di monosaccaride e un gruppo alcolico di un ‘altra molecola di un altro monosaccaride, con un eliminazione di una molecola di acqua.
Carbonio anomerico
Nei glucidi il carbonio anomerico è l’atomo di carbonio aldeidico o chetonoo che in seguito a ciclizzazione del carboidrati, viene a costituire il nuovo centro chirale.
Il centro anomerico negli emiacetali è il carbonio anomerico C-1, che è attaccato all’ossigeno emiacetalico nell’anello; negli emichetali è il carbonio C-2, attaccato all’ossigeno emichetalico. Negli aldoesosi e nei carboidrati a più basso numero di carbonio, l’atomo anomerico di riferimento è lo stereocentro più lontano dall’atomo anomerico nell’anello . Nell’α-D-glucopiranosio l’atomo di riferimento è il C-5.
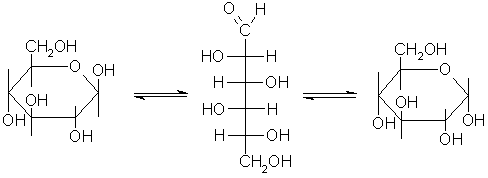
Mutarotazione
La mutarotazione è il cambiamento della rotazione specifica che accompagna l’interconversione degli anomeri alpha e beta in soluzione acquosa.
Se prendiamo una miscela pura composta al 100% di una determinata molecola, ad esempio l’alpha-D-glucopiranosio, noteremo che in pochissimo tempo la molecola genererà una interconversione tra la forma alpha e beta, mentre solo una piccolissima percentuale (circa lo 0.003%) rimarrà a catena aperta.
Quindi da una soluzione al 100% di alpha-D-glucopiranosio arriveremo ad una condizione di equilibrio con il 35.5% della miscela alpha-D-glucoprianosio, il 64.5% beta-D-glucopiranosio e lo 0.003% aperta.
Il continuo aprire e chiudere della catena e il passaggio dalla forma alpha e beta e viceversa prende il nome di mutarotazione.
La struttura più abbondante nonché la più stabile è la beta in quanto il gruppo OH che si trova in posizione N°1 (ovvero il carbonio anomerico) è più lontano (rispetto a quanto avviene nella configurazione alpha) al gruppo OH del carbonio N°2.
Ossidazione degli zuccheri ad acidi aldonici (Zuccheri riducenti)
In condizioni basiche, il gruppo aldeidico di un aldoso può essere ossidati a gruppo carbossilato. In queste condizioni la forma ciclica degli aldosi è in equilibrio con la forma a catena aperta che, successivamente, viene ossidata dal bando agente ossidante. Il D-glucosio per esempio viene ossidato a D-gluconato (l’anione dell’acido D-gluconico).
Si definisce zucchero riducente un carboidrato che reagisce con un reagente ossidante per formare un acido aldonico.
Tutti i carboidrati che sono aldeidi sono zuccheri riducenti.
Tutti i chetosi che sono in equilibrio con la relativa aldeide sono zuccheri riducenti. Ciò perché nelle condizioni basiche del saggio di Tollens (2Ag(NH3)2) si ha la tautomeria cheto-enolica che converte il chetoso in aldoso (è l’aldoso il vero zucchero riducente).